Chemische formule van zuiveringszout en zijn kenmerken. Natriumcarbonaat: formule en samenstelling
Wat natriumbicarbonaat is, ook bekend als bicarbonaat, natriumbicarbonaat of gewoon drink- of zuiveringszout, is bij velen bekend uit de scheikundelessen op school. Zuiveringszout is een zuur natriumzout van koolzuur. In de scheikunde wordt de formule van zuiveringszout gedefinieerd als NaHCO 3.
Chemische samenstelling van natriumbicarbonaat
Zoals elk voedingsproduct heeft zuiveringszout dat ook voedingswaarde, die wordt bepaald door de hoeveelheid eiwitten, mineralen, koolhydraten en macro-elementen. De samenstelling van zuiveringszout wordt bepaald door de volgende indicatoren per 100 g eetbaar deel:
- as - 36,9 g;
- water - 0,2 g;
- natrium - 27,4 g;
- selenium - 0,2 mcg.
Natriumbicarbonaat bevat geen eiwitten, vetten, koolhydraten of voedingsvezels, en het caloriegehalte is 0 kcal. De dichtheid van frisdrank is 2,16 g/cm3.
De chemische formule van soda NaHCO 3 is het zure natriumzout van koolzuur, dat volgens internationale atoommassa's 84,00 a.u. is.
Als je frisdrank met zuren laat reageren, dan chemische formule zuiveringszout zal ontleden in kooldioxide en water en zal eerst de formule hebben voor de vorming van zout en koolzuur: NaHCO 3 + HCl → NaCl + H 2 CO 3, en dan H 2 CO 3 → H 2 O + CO 2.
Thuis wordt vaker azijnzuur gebruikt, de reactie waarmee natriumacetaat ontstaat - NaHCO 3 + CH 3 COOH → CH 3 COONa + H 2 O + CO 2
Tijdens thermische reacties onder invloed van temperaturen vanaf 60 graden wordt bicarbonaat afgebroken tot natriumcarbonaat, kooldioxide en water. Kookpunt - 851°C, smeltpunt - 270°C.
Alkalische eigenschappen van frisdrank

Zuiveringszout is een alkali, deze verklaring heeft zijn eigen bewijsbasis. Oplossingen van allemaal chemicaliën bepaald door de pH-waarde, die de zuurgraad of alkaliteit van de omgeving karakteriseert.
Als de oplossing een pH van 6 of lager heeft, is deze zuur. Stoffen waarvan de oplossingen een pH van 8 of hoger hebben, zijn alkalisch.
In een neutrale omgeving (bijvoorbeeld schoon water) pH is 7. Oplossing natriumcarbonaat heeft een pH van 9, d.w.z. is een zwakke alkali en kan de eigenschappen van sterke zuren neutraliseren die gevaarlijk zijn voor het menselijk lichaam.
De formule van baking soda bevat elementen die het karakteriseren als een zachte alkali die geen agressief effect heeft op de zachte weefsels van het lichaam. Daarom worden de alkaliserende eigenschappen van dit product heel vaak gebruikt in medicinale en voor preventieve doeleinden voor het genezen van het lichaam.
Terug geïntroduceerd Sovjet-tijden Staat standaard en de technische omstandigheden van natriumbicarbonaat zorgen voor de productie ervan in overeenstemming met de standaard technologische voorschriften die in 1976 zijn vastgelegd. Deze eisen omvatten vastgelegd analysemethoden, beveiliging, acceptatie en opslag. Eerder werd GOST aangegeven - zuiveringszout onder nummer 2156-76, dat werd gebruikt in de farmacologische, chemische, lichte, voedingsmiddelenindustrie, non-ferrometallurgie, maar ook nationale economie. Op dit moment zijn de normen van deze GOST niet herzien.
Wat de fysisch-chemische componenten betreft, zou frisdrank de volgende indicatoren moeten hebben voor de klassen 1 en 2:
| Verschijning | Kristallijn poeder wit, geurloos | |
|---|---|---|
| Massafractie natriumbicarbonaat (NaHCO3), %, niet minder | 99,5 | 99,0 |
| Massafractie natriumcarbonaat (Na2CO3), %, niet meer | 0,4 | 0,7 |
| Massafractie van chloriden in termen van NaCl,%, niet meer | 0,02 | 0,04 |
| Massafractie arseen (As), %, niet meer | Doorstaat de test | |
| Massafractie van in water onoplosbare stoffen, %, niet meer | Doorstaat de test | |
| Massafractie ijzer (Fe2+), %, niet meer | 0,001 | 0,005 |
| Massafractie calcium (Ca2+), %, niet meer | 0,04 | 0,05 |
| Massafractie sulfaten in termen van SO42-, %, niet meer | 0,02 | 0,02 |
| Massafractie vocht, %, niet meer | 0,1 | 0,2 |
In deze GOST was de houdbaarheid van baking soda beperkt tot 12 maanden. In de moderne productie kent baking soda geen tijdslimieten. De belangrijkste voorwaarde is de juiste opslag.
Veiligheidseisen voor baking soda

Uit de chemische samenstelling van zuiveringszout blijkt dat het niet giftig is, maar wel explosief en ontvlambaar. Afhankelijk van de mate van impact op het menselijk lichaam, kent het een derde gevaarsklasse. In de lucht van de werkplek toegestane norm natriumbicarbonaat in de lucht 5 mg/m 3.
De chemische formule van frisdrank, evenals de samenstelling ervan, geven aan dat het onder invloed van bepaalde temperaturen ontvlambaar en explosief kan zijn. Bij verhitting kunnen de containers waarin het is opgeslagen exploderen. Bij verhitting kan frisdrank ontleden in giftige gassen, en als het stof constant in een kamer aanwezig is, kan een persoon irritatie van de luchtwegen ervaren. Mensen die in een productie werken waar veel zuiveringszout aanwezig is, moeten voorzorgsmaatregelen nemen en persoonlijke beschermingsmiddelen gebruiken.
In geval van brand is het, in overeenstemming met GOST, noodzakelijk:
- Breng de koets naar een veilige plaats. Isoleer de gevaarlijke zone binnen een straal van minimaal 100 m. Pas de opgegeven afstand aan op basis van de resultaten van chemische verkenning. Verwijder vreemden. Volg de maatregelen brandveiligheid. Niet roken. Verleen eerste hulp aan de gewonden.
- Raak gemorste of gemorste stoffen niet aan. Zorg ervoor dat de stof niet in waterlichamen, kelders of riolen terechtkomt.
- Betreed het ongevalsgebied met beschermende kleding en een ademhalingsmasker. Blus vanaf grote afstand met luchtmechanisch schuim.
- Bedek met zand of ander inert materiaal. Verbrand het gebied (individuele branden) als er gevaar bestaat voor contact met grondwater. Bel specialisten voor neutralisatie.
- Bel een ambulance. Frisse lucht, rust, warmte, schone kleding. Ogen en slijmvliezen minimaal 15 minuten met water spoelen.
Hoe frisdrank bewaren en vervoeren
Voor kwantitatief vrachtvervoer wordt baking soda voor de veiligheid verpakt in meerlaagse papieren zakken tot 50 kg, evenals in wegwerpcontainers met een polyethyleenlaag. Voor detailhandel frisdrank wordt verpakt in kartonnen dozen of dichte polyethyleenverpakkingen met een gewicht tot 1 kg. Natriumbicarbonaat wordt getransporteerd verschillende soorten vervoer, behalve door de lucht.
Hoe wordt natriumbicarbonaat geproduceerd?

In de natuur wordt baking soda (een brede groep sodamineralen) gewonnen uit gedroogde sodameren of vijvers. Door de hoge concentratie frisdrank en zouten vallen mineralen in de vorm van kristallijne sneeuwbanken aan land. Soms, wanneer meren uitdrogen, vormen ze hele lagen bedekt met zandige sedimenten. Na verloop van tijd kan zo'n laag weer boven het aardoppervlak verschijnen, waardoor het mogelijk wordt om er soda-grondstoffen uit te winnen. Er zijn verschillende soorten mineralen waaruit frisdrank kan worden gewonnen. De meest voorkomende grondstof voor de productie van frisdrank is de minerale tron, die, voordat het eindproduct wordt verkregen, een grondig reinigings- en verwarmingsproces ondergaat en ook een verbrijzelingsfase doorloopt om ongewenste gassen te verwijderen.
De grondstoffen voor de productie van frisdrank zijn natuurlijke mineraalformaties die natriumcarbonaat bevatten. Frisdrankgrondstoffen hebben verschillende chemische samenstelling, dat zowel nuttige als schadelijke componenten bevat. Er zijn 2 groepen grondstoffen bekend. De eerste omvat:
- rotsen met mineralen;
- natriumcarbonaten en bicarbonaten - trona, natron, nahkolin, thermonatriet, dawsoniet, geylussiet, shorshit;
- soda-type grondwater met verhoogde inhoud natriumcarbonaat.
Het tweede type omvat varianten van soda-afzettingen waarin afzettingen van natron, trona en haliet voorkomen. Frisdrank, dat op natuurlijke wijze wordt gewonnen uit pekel- en gedroogde meren in Kenia, Tanzania, Bolivia, Mexico en andere landen. Bovendien wordt het mineraal voor de productie van frisdrank verkregen uit dawsonietafzettingen, die werden gevormd tijdens de catagenese van zand-kleiachtige rotsen onder invloed van sodawater.
In de Sovjet-Unie werd vanwege de lage winstgevendheid de winning van natuurlijke soda door uitloging in 1971 stopgezet. De meest voorkomende was de open en schachtmethode. In de mijnen werd natriumbicarbonaat opgelost door uitloging en vervolgens werd de oplossing naar de oppervlakte gepompt.
Tegenwoordig wordt frisdrank industrieel geproduceerd met behulp van de ammoniakchloridemethode, waarbij kooldioxide wordt omgezet in een natriumchlorideconcentraat dat is verzadigd met ammoniak. Tijdens het proces van een dergelijke synthese beginnen reacties, waardoor natriumbicarbonaat door filtratie wordt gescheiden en de verwerkte producten (ammoniak) weer in productie worden genomen.
Veelgebruikt zuiveringszout, waarvan de chemische formule NaHCO 3 is, wordt momenteel niet verkregen door frisdrank op natuurlijke wijze te zuiveren, maar op chemische wijze.
In het laboratorium worden ook kristallen van natuurlijke zouten gekweekt. Zuivering van natriumbicarbonaat wordt op twee manieren uitgevoerd: nat en droog. Algemeen proces is een carbonisatiereactie - de verzadiging van een oplossing met kooldioxide, waardoor het herkristallisatieproces plaatsvindt, en de methoden verschillen alleen in de methode voor het bereiden van de oplossing.
Moderne consumenten van natriumbicarbonaat - zuiveringszout kunnen het in producten zien als een voedingsadditief E500.
In dit artikel zullen we leren wat natriumcarbonaat is en waarvoor het nodig is. Een eenvoudige uitleg wordt gegeven in een scheikundeboek van de 9e klas. Natriumcarbonaat is een stof die wordt verkregen door het calcineren van natriumkristallen die watermoleculen bevatten. Chemici noemen het natriumcarbonaat.
De formule voor natriumcarbonaat is Na 2 CO 3 (natriumcarbonaat).
In het dagelijks leven wordt soda vaak gebruikt - Na 2 CO 3 10H 2 O.
Het werd gecalcineerd genoemd omdat het werd geproduceerd door middel van calcineren - dit is wanneer de stof ontleedt waarbij water vrijkomt.
Verbinding
De stof bestaat uit witte kristallen en lijkt op witte bloem of zout, afhankelijk van het merk.
Natriumcarbonaat verschilt van zuiveringszout en natronloog: andere samenstelling, kenmerken en pH-waarde. De waarde van natriumbicarbonaat is 8,1 PH, natriumcarbonaat is 11 PH, natriumhydroxide is 13 PH. Natriumcarbonaat kan niet oraal worden ingenomen, in tegenstelling tot zuiveringszout. Bijtende soda veroorzaakt over het algemeen chemische brandwonden. Het wordt verkregen uit gecalcineerd staal bij een temperatuur van 1200°C door sinteren met ijzeroxide.
Specificaties
Beschrijving van de kenmerken van technische natriumcarbonaat:
- Dichtheid: 2,53 g/cm³;
- Gewicht (molaire massa): 105,99 g/mol;
- Code voor de voedingsindustrie: 500I;
- Houdbaarheid: 5 jaar, indien bewaard in speciale verpakking;
- Gevarenklasse: niveau 3. Veilig bij brand en explosies. .
Voor natriumcarbonaat tot 2020.
In het dagelijks leven, gecalcineerd technische frisdrank kan worden vervangen door voedsel. Het zal minder effectief zijn vanwege het lagere alkaligehalte.
Eigenschappen
Interessante feiten over de eigenschappen van natriumcarbonaat:
- Gemakkelijk oplosbaar in water en glycerine;
- Verandert de vorm van kristallijne hydraten afhankelijk van verwarming;
- Verzacht water, reinigt harde oppervlakken;
- Een eetlepel bevat 7,7 gram.
Ontvangst
Voor het eerst werd natriumcarbonaat uit de natuur gewonnen: zeewier en mineralen.
In 1791 begonnen fabrieken natriumcarbonaat te produceren volgens de methode van Nicolas Leblanc. Keukenzout werd behandeld met zwavelzuur, gemengd met steenkool en kalksteen, gesmolten in ovens tot 1000 °C en gekoeld met water. Zijn methode werd tot het begin van de 20e eeuw gebruikt.
Momenteel wordt de Solvay-methode gebruikt. Een schijn van ammoniumbicarbonaat wordt uit een natriumchlorideoplossing verwijderd. Gefilterd en gecalcineerd. Er wordt calciumhydroxide toegevoegd.
Fabrieken produceren natriumcarbonaat van kwaliteit A (met korrels) en klasse B (in poedervorm).
Video over hoe je natriumcarbonaat thuis kunt maken.
Waar wordt het gebruikt?
Technische natriumcarbonaat wordt gebruikt:
- Bij de vervaardiging van verschillende soorten glas, kristal, keramische tegels;
- Bij de productie van wasmiddelen;
- In de verf- en lak-, pulp- en papier- en olie-industrie;
- Bij de productie van zink, chroom, strontium, wolfraam, lood;
- Om de waterhardheid te verminderen.
Natriumcarbonaat wordt ook gebruikt om foto's te ontwikkelen. Het is nodig voor de chemische ontwikkelaaroplossing.
Waar wordt het verkocht?
Natriumcarbonaat wordt verkocht in huishoudelijke winkels. Je kunt het ophalen in het wasmiddelvak. Gemiddelde prijs - 50 roebel/kg (Mark B - poeder).
Staatsonderwijsinstelling
Hoger beroepsonderwijs
"Perm State Farmaceutische Academie
Federaal Agentschap voor Gezondheid en Sociale Ontwikkeling
Russische Federatie"
Afdeling Analytische Chemie
Cursussen:
Natriumcarbonaat.
Voltooid:
leerling van groep 26
Lekomtseva Veronica
Gecontroleerd:
Lidia Andrejevna
Permanent, 2010
Analytische reacties van natriumkation 5
Analytische reacties van carbonaation 6
Zuur-base-titratie in waterige oplossingen 8
Potentiometrische methode 9
Natriumcarbonaat (beschrijving van de stof) 3
4 manieren om het te krijgen
Kwalitatieve analyse 5
Kwantitatieve analyse 8
Instrumentele analyse 9
Praktische toepassing van natriumcarbonaat 10
Referenties 11
Natriumcarbonaat.
Samengestelde formule:
Chemische naam:
Natriumcarbonaat. Natriumcarbonaat.
SODA– technische naam voor natriumcarbonaten. Na 2 CO 3 is normaal carbonaat of natriumcarbonaat (watervrij).
Na 2 CO 3 zijn kleurloze kristallen, met een oplosbaarheid in 100 g water bij een temperatuur van 20ºC gelijk aan 14,9 g. Waterige oplossingen een alkalische reactie hebben.
Natuurlijke bronnen zijn van ondergeschikt belang (mineralen: natron, thermonatrium, trona).
Ontvangst:
Natriumcarbonaat wordt voornamelijk verkregen door een oplossing van natriumchloride te verzadigen met ammoniak en kooldioxide en verder te verwarmen tot 140 ° - 160 ° C, evenals uit nefeline.
Kwalitatieve analyse.
Kwalitatieve analyse is de identificatie van anorganische stoffen op basis van de detectie, met behulp van analytische reacties, van kationen en anionen die het molecuul van de stof vormen.
3.1. Reacties voor de bepaling van natriumkation.
Reactie met zinkdixouran (VI) acetaat Zn(UO 2) 3 (CH 3 COO) 3 om een geel kristallijn neerslag of gele kristallen met een tetraëdrische en octaëdrische vorm te vormen, onoplosbaar in azijnzuur. Om de gevoeligheid van de reactie te vergroten, moet het testmengsel op een glasplaatje worden verwarmd:
NaNO 2 + Zn(UO 2) 3 (CH 3 COO) 3 + CH 3 COOH + 9H 2 O →
→NaZn(UO 2) 3 (CH 3 COO) 9 x 9H 2 O↓ + HNO 2
Overtollige kaliumionen, kationen van zware metalen (Hg 2+, Sn 2+, Bi 3+, Fe 3+, enz.). De reactie wordt gebruikt als een fractionele reactie na het verwijderen van storende ionen.
Kleur de kleurloze brandervlam geel.
Reactie met picrinezuur, onder vorming van gele, naaldvormige kristallen van natriumpicraat, afkomstig uit één punt:
De reactie wordt alleen als fractionele reactie gebruikt in afwezigheid van interfererende ionen (K +, NH 4+, Ag +).
Reactie met kaliumhexahydroxostibaat (V) K om een wit kristallijn neerslag te vormen, oplosbaar in alkaliën:
NaNO 2 + K → Na ↓ + KNO 2
Reactieomstandigheden:
Voldoende concentratie Na+;
Neutrale oplossingsreactie;
Het uitvoeren van de reactie in de kou;
Een glazen staafje tegen de wand van een reageerbuisje wrijven.
Storende ionen: NH 4+, Mg 2+, enz.
In een zure omgeving wordt het reagens vernietigd onder vorming van een wit amorf neerslag van metaantimonzuur HSbO 3:
K + HCl → KCl + H 3 SbO 4 + 2H 2 O
H 3 SbO 4 → HSbO 3 ↓ + H 2 O.
Reacties om carbonaation te bepalen.
Kwantitatieve analyse.
4.1. Zuur-base-titratie in waterige oplossingen.
Standaardisatie van 0,1 M zwavelzuuroplossing
door nauwkeurig wegen van natriumcarbonaat (methode van individueel wegen).
Na 2 CO 3 + H 2 SO 4 → Na 2 SO 4 + CO 2 + H 2 O
M (Na2C03) = 105,99 g/mol
Methodologie: 0,05-0,07 g (exact afgewogen) natriumcarbonaat wordt kwantitatief overgebracht in een titratiekolf, opgelost in 25 cm3 gedestilleerd water, 2-3 druppels methyloranje-oplossing worden toegevoegd en getitreerd met 0,1 M zwavelzuuroplossing totdat de kleur geel wordt tot roze-oranje.
De correctiefactor voor zwavelzuuroplossing wordt berekend met behulp van de formule:
Instrumentele analyse.
5.1. Potentiometrische methode.
De potentiometrische analysemethode is gebaseerd op het gebruik van de afhankelijkheid van de elektromotorische kracht (EMF) van de elektrochemische cel van de concentratie van de analyt in de oplossing.
Potentiometrische bepaling van natriumhydroxide en carbonaat
wanneer samen aanwezig.
De bepaling van de componenten van een mengsel in een oplossing is gebaseerd op hun gedifferentieerde titratie met een oplossing van zoutzuur met de fixatie van twee equivalentiepunten op basis van een scherpe sprong in potentieel. Een glaselektrode wordt gebruikt als indicatorelektrode en een zilverchloride-elektrode wordt gebruikt als referentie-elektrode. Een oplossing van een mengsel van natriumhydroxide en natriumcarbonaat kan tegelijkertijd Na +, OH -, HCO 3 -, CO 3 2- ionen bevatten:
NaOH → Na + + OH -
Na 2 CO 3 → 2 Na + + CO 3 2-
CO 3 2- + H 2 O ↔ HCO 3 - + OH -
HCO 3 - + H 2 O ↔ H 2 CO 3 + OH -
De aanwezigheid van natriumhydroxide remt de hydrolyse van natriumcarbonaat, dus bij het titreren van een mengsel van deze verbindingen met een zuur wordt eerst natriumhydroxide getitreerd. Naarmate het alkaligehalte in de oplossing afneemt, vindt hydrolyse van natriumcarbonaat plaats in de eerste fase en de interactie ervan met de titrant.
In dit geval vindt de hydrolyse van natriumcarbonaat in de tweede fase en de titratie van hydrolyseproducten niet plaats, omdat de ionisatieconstanten van de overeenkomstige basen met vier ordes van grootte verschillen:
In dit geval wordt de eerste titratiesprong waargenomen (pH 8,3):
NaOH + HCl → NaCl + H2O
Na 2 CO 3 + HCl → NaCl + NaHCO 3
Vervolgens wordt natriumbicarbonaat getitreerd, waarbij een tweede titratiesprong wordt waargenomen (pH 3,8):
NaHCO 3 + HCl → NaCl + CO 2 + H 2 O
M NaOH = 40,00 g/mol
M Na 2 CO 3 = 105,99 g/mol
Methodologie: 2-4 cm3 van de geanalyseerde oplossing wordt met een magnetische staaf in een glas met een inhoud van 50 cm3 geplaatst, er wordt gedestilleerd water aan het volume toegevoegd.
De buret wordt gevuld met een zoutzuuroplossing van 0,1 mol/dm3 en de standaard wordt vastgezet. Het glas met de geanalyseerde oplossing wordt op de tafel van de elektromagnetische roerder geplaatst, de elektroden worden ondergedompeld in de oplossing en de titratie begint. Geschatte en nauwkeurige titraties worden uitgevoerd volgens de algemene instructies, waarbij twee titratiesprongen worden geregistreerd op basis van een scherpe potentiaalverandering. De meetresultaten worden in tabellen vastgelegd.
Met behulp van integrale of differentiële grafieken vindt men:
V 1 – volume titrant overeenkomend met de eerste titratiesprong, reagerend met alle alkali en ½ hoeveelheid natriumcarbonaat tot NaHCO 3;
V totaal is het volume titrant dat overeenkomt met de tweede titratiesprong, gereageerd met alkali en natriumcarbonaat.
Bereken op basis van de titratieresultaten:
V 2 = V totaal - V 1 – volume titrant verbruikt voor titratie
½ Na2C03 tot NaHCO3;
V 3 = 2 V 2 = 2(V totaal - V 1) – volume verbruikte titrant
voor titratie van alle Na 2 CO 3 ;
V 4 = (V 1 - V 2) – volume titrant dat wordt verbruikt voor de titratie van NaOH.
Q en ω% worden vervolgens berekend.
Praktische toepassing.
Gebruikt in de glas-, zeep-, textiel-, pulp- en papierindustrie; voor oliezuivering, enz.
Referenties.
Lurie Yu.Yu. "Handbook of Analytical Chemistry", Moskou, 1979;
Methodisch handboek over analytische chemie.
“Instrumentele analysemethoden”, Perm, 2004;
Methodisch handboek over analytische chemie.
“Kwalitatieve chemische analyse”, Perm, 2003;
Methodisch handboek over analytische chemie.
"Kwantitatieve chemische analyse", Perm, 2004;
"New Illustrated Encyclopedia", deel nr. 8, 12, 17. Moskou,
Boek Wereld LLC, 2001;
Rabinovich V.A., Khavin Z.Ya. “Een kort chemisch naslagwerk”, Leningrad, Khimiya, 1977;

Kharitonov Yu.Ya. “Analytical Chemistry”, in 2 boeken, Moskou, 2001.
Bij het bakken van peperkoek gebruiken ze de eigenschap van natriumbicarbonaat om chemisch te reageren met zuur, waarbij kooldioxide ontstaat. Dit vermogen van frisdrank is al heel lang bekend; het wordt gebruikt om structuur en porositeit toe te voegen. Neem hiervoor natriumbicarbonaat en blus het met azijn. Het resulterende mengsel begint heftig met elkaar te reageren. Blussoda is een spectaculair gezicht: er ontstaat veel schuim en er is een luid sissend geluid. Je moet het snel aan het deeg toevoegen en goed mengen.
Natriumbicarbonaat is geregistreerd als levensmiddelenadditief. De markering is E500.
Het lijkt erop wat er mis is met deze frisdrank, maar in feite wordt de structuur van het deeg compleet anders. De gebakken goederen worden "pluizig", zacht en mooi gemaakt. Zuiveringszout wordt gebruikt bij het bakken, wanneer verschillende zoetwaren worden gemaakt. Het kan soms ook worden gebruikt om mousserende dranken te maken, zoals mineraal- en koolzuurhoudend water en mousserende wijnen. De voedingsindustrie zal voortdurend zuiveringszout gebruiken.: het herstelt perfect het zuur-base-evenwicht in het spijsverteringsstelsel, is in staat het cellulaire metabolisme te herstellen, zorgt ervoor dat kalium niet uit de lichaamscellen wordt gespoeld en helpt weefsels zuurstof te absorberen. Uit het bovenstaande volgt dat frisdrank een belangrijk eerstehulpmiddel is.
Daarom wordt natriumbicarbonaat gebruikt tegen brandend maagzuur, omdat het een maagzuurremmende werking heeft. De eigenschap van het drinken van frisdrank stelt je in staat zich te ontdoen van de onaangename sensaties die hierdoor ontstaan verhoogde zuurgraad. Met behulp van het drinken van een frisdrankoplossing verdwijnen de symptomen. Maar in de geneeskunde zijn er andere opties voor het gebruik van natriumbicarbonaat:
- Bij misselijkheid en braken helpt een zout-soda-oplossing de verloren waterreserves aan te vullen en de vochtbalans in het lichaam te herstellen.
- Voor de behandeling van hart- en vaatziekten (hypertensie, oedeem en hartritmestoornissen) wordt ook een niet-geconcentreerde frisdrankoplossing gebruikt.
- Als verdunningsmiddel dat slijm verwijdert ademhalingssysteem, waardoor de persoon wordt verlost van hoesten. Het wordt gebruikt voor inhalatie bij verkoudheid.
- Als eerste hulp bij kleine brandwonden.
- Om schimmelinfecties te vernietigen, voetschimmel te elimineren, spruw te behandelen met douchen en spoelingen uit te voeren voor conjunctivitis.
- Als assistent bij het bevrijden van een persoon van zouten van zware metalen.
- Bij het tandenpoetsen voor een witmakend effect.
- Als middel om huiduitslag te verlichten en jeuk te verlichten. Dit geldt ook voor insectenbeten.
- Om een ontstekingsremmend effect te bereiken.
- Bij het nemen van een warm bad, wanneer frisdrank aan het water wordt toegevoegd, samen met essentiële oliën, ontspant het lichaam, raakt de persoon van vermoeidheid af en is hij opgelucht.
- Farmaceutische producten gebruiken natriumbicarbonaat om medicijnen tegen tuberculose, antibiotica en injectieoplossingen te produceren.

Zuiveringszout, dat als medicijn of als effectief hulpmiddel fungeert, is nuttig. Zoals iedereen geneesmiddel, heeft contra-indicaties en doseringsaanbevelingen. Verkeerd gebruik kan schadelijk zijn.
Lichte en chemische industrie
De chemische industrie gebruikt frisdrank voor haar behoeften. Met zijn hulp worden middelen gecreëerd om brand te bestrijden. Zuiveringszout is een ingrediënt in poederbrandblussers. Het werkt door kooldioxide vrij te geven en zuurstof weg te duwen van het ontstekingspunt.
In de productie worden machines, machines en oppervlakken gereinigd van relevante verontreinigingen met behulp van ASO-technologie (abrasive blast cleaning). NaHCO3 werkt als maalmateriaal. Deze methode reinigen met baking soda is een hoogwaardige technologie waarbij deze stof zacht werkt.
Wanneer de compressor in werking is, wordt het schuurmiddel met behulp van perslucht verplaatst. Het voordeel van het gebruik van deze technologie ten opzichte van zandstralen is dat soda zachter is dan zand en geen krassen maakt op oppervlakken.
Ook de lichte industrie gebruikt natriumbicarbonaat voor oppervlaktebehandeling bij het maken van rubberen zolen en andere producten. Zuiveringszout wordt ook gebruikt bij de productie van kunstleer- en textielproducten. Het is nuttig omdat het een goed additief is en tevens een ontvetter. Het wordt gebruikt bij het looien van leer en het maken van producten. Ook in de textielwerkplaats doet natriumbicarbonaat uitstekend werk bij het bleken van stof. Langdurig contact met zuiveringszout kan brandwonden veroorzaken, en dit negatieve invloed natriumbicarbonaat.
Ook de lichte en chemische industrie kunnen niet zonder natriumbicarbonaat.
Huishoudelijke behoeften

Frisdrank is zo'n nuttige stof dat het bij elke stap in het dagelijks leven van pas zal komen.
- Als je melk moet koken, maar je bent er niet helemaal zeker van dat deze niet gaat schiften, voeg er dan een snufje zuiveringszout aan toe.
- Als het buiten warm is, kun je je oksels afvegen met een frisdrankoplossing onaangename geur dat zal er niet zijn.
- Om salmonellose op de schaal te voorkomen, moet deze worden gewassen met een frisdrankoplossing voordat deze als voedsel wordt gebruikt.
- Zuiveringszout is een waterontharder en heeft tevens een blekende werking.
- Groenten en fruit moeten vóór het serveren worden behandeld met water en frisdrank.
- Het helpt de geuren van vis, uien enz. uit borden en handen te verwijderen.
- Afwassponsen moeten een nacht in een soda-oplossing worden gedrenkt, dit zal ze desinfecteren en geurtjes verwijderen.
- Wanneer de haarlak verschijnt en uitwast, voeg dan zuiveringszout toe aan de shampoo.
- Om vlees indien nodig te desinfecteren, moet u het afvegen met natriumbicarbonaat en het laten staan bepaalde tijd en spoel vervolgens goed af onder stromend water.
- Keuken huishoudelijke apparaten zoals een magnetron, koelkast, koffiezetapparaat, sapcentrifuge en nog veel meer kunnen zonder problemen met frisdrank worden gewassen.
Het is goed dat binnen het dagelijks leven, we hebben de mogelijkheid om frisdrank te gebruiken. Met deze assistent wordt het dagelijks leven vriendelijker voor mensen.
Terwijl je de video bekijkt, leer je over de voordelen van baking soda.
Frisdrank heeft inderdaad een aantal voordelen die het voor mensen zo noodzakelijk maken. De genezende, desinfecterende, ontspannende, blekende en helende eigenschappen ervan worden op veel gebieden van ons leven gebruikt.
Zuiveringszout, of frisdrank, is een stof die algemeen bekend is in de geneeskunde, het koken en de huishoudelijke consumptie. Dit is een zuur zout, waarvan het molecuul wordt gevormd door positief geladen natrium- en waterstofionen, en het anion van de zure rest van koolzuur. Chemische naam frisdrank - natriumbicarbonaat of bicarbonaat. Formule van de verbinding volgens het Hill-systeem: CHNaO 3 (brutoformule).
Het verschil tussen zuurzout en middelzout
Koolzuur vormt twee groepen zouten: carbonaten (medium) en bicarbonaten (zuur). De triviale naam voor carbonaten - frisdrank - verscheen in de oudheid. Het is noodzakelijk om onderscheid te maken tussen medium- en zure zouten op basis van namen, formules en eigenschappen.
Na 2 CO 3 - natriumcarbonaat, dinatriumcarbonaat, natriumcarbonaat. Dient als grondstof voor de productie van glas, papier, zeep en wordt gebruikt als wasmiddel.
NaHCO 3 - natriumbicarbonaat. De samenstelling suggereert dat de stof een mononatriumzout van koolzuur is. Deze verbinding onderscheidt zich door de aanwezigheid van twee verschillende positieve ionen: Na + en H +. Uiterlijk zijn de kristallijne witte stoffen vergelijkbaar, ze zijn moeilijk van elkaar te onderscheiden.
De stof NaHCO 3 wordt niet als zuiveringszout beschouwd omdat het inwendig wordt gebruikt om de dorst te lessen. Hoewel deze stof kan worden gebruikt om een koolzuurhoudende drank te bereiden. Een oplossing van dit bicarbonaat wordt oraal ingenomen in geval van verhoogde zuurgraad van het maagsap. In dit geval worden de overtollige H+-protonen geneutraliseerd, die de wanden van de maag irriteren en pijn en een branderig gevoel veroorzaken.
Fysische eigenschappen van zuiveringszout
Bicarbonaat is witte monokliene kristallen. Deze verbinding bevat atomen natrium (Na), waterstof (H), koolstof (C) en zuurstof. De dichtheid van de stof is 2,16 g/cm3. Smeltpunt - 50-60 °C. Natriumbicarbonaat is een melkwit poeder, een vaste, fijnkristallijne verbinding, oplosbaar in water. Zuiveringszout brandt niet en valt bij verhitting boven de 70 ° C uiteen in natriumcarbonaat, kooldioxide en water. In productieomstandigheden wordt vaker bicarbonaat in korrelvorm gebruikt.

Veiligheid van zuiveringszout voor mensen
De verbinding is geurloos en de smaak is bitter en zout. Het wordt echter afgeraden om de stof te ruiken of te proeven. Het inademen van natriumbicarbonaat kan niezen en hoesten veroorzaken. Eén gebruik is gebaseerd op het vermogen van zuiveringszout om geuren te neutraliseren. Poeder kan worden verwerkt sportschoenen om zich te ontdoen van onaangename geur.
Zuiveringszout (natriumbicarbonaat) is in contact met de huid een ongevaarlijke stof, maar kan in vaste vorm irritatie veroorzaken aan de slijmvliezen van de ogen en de slokdarm. In lage concentraties is de oplossing niet giftig en kan oraal worden ingenomen.
Natriumbicarbonaat: samengestelde formule
De brutoformule CHNaO 3 wordt zelden in vergelijkingen aangetroffen chemische reacties. Feit is dat het niet de verbinding weerspiegelt tussen de deeltjes die natriumbicarbonaat vormen. De formule die gewoonlijk wordt gebruikt om de fysische en chemische eigenschappen van een stof te karakteriseren is NaHCO 3 . Wederzijdse positie atomen wordt weerspiegeld door het bal-en-stokmodel van het molecuul:

Als u de waarden uit het periodiek systeem ontdekt atomaire massa's natrium, zuurstof, koolstof en waterstof. dan kun je rekenen molaire massa stoffen natriumbicarbonaat (formule NaHCO 3):
Ar(Na) - 23;
Ar(O)-16;
Ar(C) - 12;
Ar(H)-1;
M (CHNaO 3) = 84 g/mol.
Structuur van de materie
Natriumbicarbonaat is een ionische verbinding. Inbegrepen kristal rooster omvat het natriumkation Na +, dat één waterstofatoom in koolzuur vervangt. De samenstelling en lading van het anion is HCO 3 -. Bij oplossing vindt gedeeltelijke dissociatie plaats in ionen die natriumbicarbonaat vormen. De formule die de structurele kenmerken weergeeft, ziet er als volgt uit:

Oplosbaarheid van zuiveringszout in water
7,8 g natriumbicarbonaat lost op in 100 g water. De stof ondergaat hydrolyse:
NaHCO 3 = Na++ + HCO 3 - ;
H 2 O ↔ H ++ OH - ;
Bij het samenvatten van de vergelijkingen blijkt dat hydroxide-ionen zich ophopen in de oplossing (zwak alkalische reactie). De vloeistof kleurt fenolftaleïne roze. De kleur van universele indicatoren in de vorm van papieren stroken in een frisdrankoplossing verandert van geeloranje naar grijs of blauw.
Uitwisselingsreactie met andere zouten
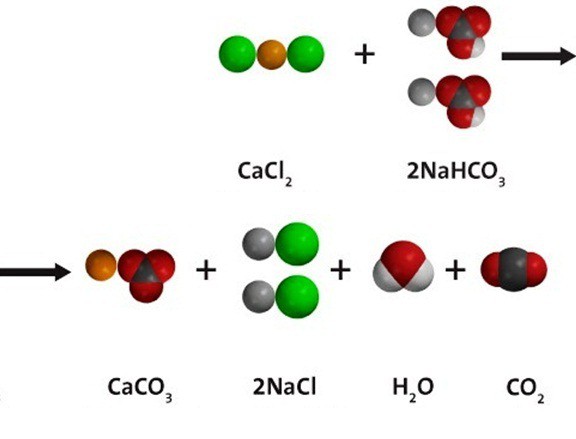
Een waterige oplossing van natriumbicarbonaat gaat ionenuitwisselingsreacties aan met andere zouten, op voorwaarde dat een van de nieuw gevormde stoffen onoplosbaar is; of er ontstaat een gas dat uit de reactiesfeer wordt verwijderd. Bij interactie met calciumchloride, zoals weergegeven in het onderstaande diagram, wordt zowel een wit neerslag van calciumcarbonaat als kooldioxide verkregen. Natrium- en chloorionen blijven in de oplossing achter. Moleculaire vergelijking van de reactie:
Interactie van zuiveringszout met zuren
Natriumbicarbonaat reageert met zuren. De ionenuitwisselingsreactie gaat gepaard met de vorming van zout en zwak koolzuur. Op het moment van ontvangst valt het uiteen in water en kooldioxide (verdampt).
De wanden van de menselijke maag produceren zoutzuur, dat bestaat in de vorm van ionen
H+ en Cl-. Als u natriumbicarbonaat oraal inneemt, treden er reacties op in een oplossing van maagsap met de deelname van ionen:
NaHCO 3 = Na++ + HCO 3 - ;
HCl = H++Cl-;
H2O ↔ H+ + OH-;
HCO 3 - + H + = H 2 O + CO 2.
Artsen raden niet aan om voortdurend natriumbicarbonaat te gebruiken in geval van verhoogde maagzuurgraad. De instructies voor de medicijnen vermelden verschillende bijwerkingen van dagelijks en langdurig gebruik van zuiveringszout:
- verhoogde bloeddruk;
- boeren, misselijkheid en braken;
- angst, slechte slaap;
- verminderde eetlust;
- buikpijn.
Baksoda halen
In het laboratorium kan natriumbicarbonaat worden verkregen uit natriumcarbonaat. Dezelfde methode werd eerder gebruikt bij de productie van chemicaliën. De moderne industriële methode is gebaseerd op de interactie van ammoniak met kooldioxide en de lage oplosbaarheid van zuiveringszout daarin koud water. Ammoniak en kooldioxide (kooldioxide) worden door de natriumchlorideoplossing geleid. Er worden ammoniumchloride en natriumbicarbonaatoplossing gevormd. Bij afkoeling neemt de oplosbaarheid van zuiveringszout af, waarna de substantie gemakkelijk wordt gescheiden door filtratie.
Waar wordt natriumbicarbonaat gebruikt? Gebruik van zuiveringszout in de geneeskunde
Veel mensen weten dat natriummetaalatomen een krachtige wisselwerking hebben met water, zelfs met de damp ervan in de lucht. De reactie begint actief en gaat gepaard met het vrijkomen grote hoeveelheid hitte (verbranding). In tegenstelling tot atomen zijn natriumionen stabiele deeltjes die een levend organisme niet schaden. Integendeel, ze accepteren het actieve deelname bij het reguleren van zijn functies.
Hoe wordt een stof, natriumbicarbonaat, die niet giftig is voor de mens en in veel opzichten nuttig is, gebruikt? Toepassing is gebaseerd op fysieke en chemische eigenschappen natriumcarbonaat. De belangrijkste gebieden zijn de huishoudelijke consumptie, voedingsindustrie, gezondheidszorg, traditionele geneeskunde, drankjes verkrijgen.
Een van de belangrijkste eigenschappen van natriumbicarbonaat is de neutralisatie van verhoogde zuurgraad van maagsap, eliminatie op korte termijn van pijn als gevolg van hyperaciditeit van maagsap, maagzweren en darmzweren. Het antiseptische effect van baking soda-oplossing wordt gebruikt bij de behandeling van keelpijn, hoest, intoxicatie en zeeziekte. Was ermee de mond- en neusholten en de slijmvliezen van de ogen.

Er worden veel verschillende doseringsvormen van natriumbicarbonaat gebruikt, zoals poeders, die worden opgelost en voor infusie worden gebruikt. Er worden oplossingen voorgeschreven die patiënten oraal kunnen innemen, en brandwonden worden gewassen met zuren. Natriumbicarbonaat wordt ook gebruikt om tabletten en rectale zetpillen te maken. De instructies voor de medicijnen bevatten gedetailleerde beschrijving farmacologische werking, indicaties. De lijst met contra-indicaties is erg kort: individuele intolerantie voor de stof.
Thuis baking soda gebruiken
Natriumbicarbonaat is een “ambulance” voor brandend maagzuur en vergiftiging. Door thuis zuiveringszout te gebruiken, kunt u uw tanden witter maken, ontstekingen tijdens acne verminderen en de huid afvegen om overtollige olieachtige afscheidingen te verwijderen. Natriumbicarbonaat verzacht water en helpt vuil van verschillende oppervlakken te verwijderen.
Bij handwas Voor artikelen gemaakt van wollen breiwerk kunt u zuiveringszout aan het water toevoegen. Deze stof verfrist de kleur van de stof en verwijdert de geur van zweet. Bij het strijken van zijdeproducten verschijnen vaak gele vlekken van het strijkijzer. In dit geval zal een pasta van zuiveringszout en water helpen. De stoffen moeten zo snel mogelijk worden gemengd en op de vlek worden aangebracht. Wanneer de pasta droog is, moet deze met een borstel worden schoongemaakt en moet het product in koud water worden afgespoeld.
Bij de reactie met azijnzuur wordt natriumacetaat verkregen en komt kooldioxide snel vrij, waardoor de gehele massa schuimt: NaHCO 3 + CH 3 COOH = Na + + CH 3 COO - + H 2 O + CO 2. Dit proces vindt plaats wanneer bij de vervaardiging van koolzuurhoudende dranken en zoetwaren zuiveringszout wordt "geblust" met azijn.

De smaak van gebak zal delicater zijn als u citroensap gebruikt in plaats van synthetische azijn die u in de winkel koopt. Als laatste redmiddel kunt u het vervangen door een mengsel van 1/2 theelepel. poeder citroenzuur en 1 eetl. l. water. Zuiveringszout met zuur wordt als een van de laatste ingrediënten aan het deeg toegevoegd, zodat je het baksel meteen in de oven kunt zetten. Naast natriumbicarbonaat wordt soms ammoniumbicarbonaat als rijsmiddel gebruikt.